2022年5月25日 14:00
明治大学大学院農学研究科環境バイオテクノロジー研究室の片山 徳賢(博士後期課程2年兼日本学術振興会特別研究員DC1)、小山内 崇准教授らの研究グループは、モデルラン藻のアルギニン生合成の最終段階であるアルギニノコハク酸リアーゼという酵素がアルギニンによって阻害されることを発見しました。
<研究成果のポイント>
●ラン藻のアルギニン生合成については、初期段階の阻害や、アルギニンの代謝について知られていたが、アルギニンを直接合成する最終段階の酵素の特徴はよく分かっていなかった。
●モデルラン藻のアルギニノコハク酸リアーゼは、アルギニンによって阻害されることが分かり、他のラン藻も同様に阻害されることが分かった。
●ラン藻のアルギニノコハク酸リアーゼのアルギニンによる阻害は、反応液中のpHによって変化することが分かり、低いpHで阻害効果が弱まることが分かった。
●本研究の成果は、原核生物で初めてアルギニノコハク酸リアーゼのアルギニンによる阻害と、ラン藻の生体内におけるアルギニン生合成の制御についてpHとアルギニンの濃度が関与していることを示した。
要旨
アルギニンというアミノ酸は、1分子内に4つの窒素原子を持ち、タンパク質の構成要素だけでなく、窒素の供給源としても重要です。生体内でのアルギニンの生合成経路は、多くの窒素やエネルギーを必要とするため、厳しく制御されていることが、これまでの研究で分かっています。しかしながら、これまでアルギニン生合成系の最終段階である、アルギニンを生成する反応については着目されていませんでした。アルギニンの生成を担う酵素が、アルギニノコハク酸リアーゼ(ArgH)です。ラン藻は、植物や藻類と同じ酸素発生型の光合成を行う細菌です。このラン藻は、シアノフィシンと呼ばれるアルギニンとアスパラギン酸から構成される窒素の貯蔵物を合成することが知られています。
また、ラン藻にとって、アルギニンは重要な窒素の供給源の一つです。
本研究グループは、ラン藻の一種であるシネコシスティス注1)のアルギニノコハク酸リアーゼ(SyArgH)を精製し、生化学的性質を調べました。さらに、同じラン藻の中でも糸状性のスピルリナ注2)、窒素を固定する能力のあるノストック注3)というラン藻のArgH(ArArgH, NoArgH)の生化学的性質を調べました。その結果、SyArgHやArArgHは、NoArgHよりも活性が低いことが分かりました。また、ラン藻のArgHは、アルギニンにより、阻害されることが保存されていました。また、アルギニンによる阻害は、pHによって変化する事も分かりました。しかしながら、アルギニンと構造が似ているリジンというアミノ酸では阻害をほとんど受けず、アルギニンによる阻害は、特異的であることが分かりました。
このように、本研究ではアルギニンによる酵素活性の阻害がラン藻のアルギニノコハク酸リアーゼという酵素において保存されていること、またpHによってその阻害の強度が変化することを発見しました。このことは、ラン藻が生育するうえで、細胞内のpHやアルギニン濃度によって、アルギニンの生合成を制御していることが示唆されました。
この研究は、明治大学大学院農学研究科 片山 徳賢(博士後期課程2年)、小山内崇准教授らのグループによって行われました。この研究は、科学技術振興機構(JST)による戦略的創造研究推進事業先端的低炭素化技術開発ALCA(代表小山内崇)、日本学術振興会による科学研究費基盤B(代表小山内崇)および特別研究員奨励費(代表片山徳賢)の援助により行われました。
本研究成果は、2022年5月18日発行の国際誌「Plant Molecular Biology」に掲載されました。
※研究グループ
明治大学 大学院農学研究科
環境バイオテクノロジー研究室
准教授 小山内 崇(おさない たかし)
博士後期課程2年生 片山 徳賢(かたやま のりあき)
1.背景
循環可能型社会実現に向け、地球温暖化対策や非化石燃料の導入拡大が求められる近年、持続可能性の高いバイオプラスチックやバイオ燃料が注目を集めています。そうした状況の中で、私たちの研究グループは、光合成によって固定した二酸化炭素を炭素源として利用できるラン藻という細菌に注目しています。ラン藻は、培養に糖の添加が必要ないだけでなく、食料や農地との競合も少ないというメリットを持ちます。このような、ラン藻を用いた有用物質生産に関する研究は世界中で盛んに行われています。特に、ラン藻の糖分解にかかわる酵素の生化学的な特質は近年多くの研究が報告されています。
しかしながら、このラン藻自体のアミノ酸生合成に関する基礎的な知見は、従属栄養微生物である大腸菌や酵母に比べて乏しく、ラン藻の代謝システムの解明が求められています。ラン藻の中でも比較的取り扱い易く、モデルラン藻として世界中で広く研究されているのが、シネコシスティスです。また、ラン藻の中には多様な形態・生態を持つ種類があり、例えば糸状性のスピルリナや、空気中の窒素を固定することで、自ら窒素源を作ることのできるノストックといった種類のラン藻が存在しています。ラン藻は、シアノフィシンと呼ばれるアルギニンとアスパラギン酸から構成される窒素の貯蔵物質を作ることが知られています。
また、窒素を固定することのできないシネコシスティスは、環境中のアルギニンを取り込む能力がノストックの31倍であることが報告されています。
アルギニンは、1つの分子の中に4つの窒素原子を持っているアミノ酸であり、タンパク質の構成物質としてだけでなく、窒素源としても重要です。アルギニンは、グルタミン酸を出発物質として多段階の酵素反応を経て、生体内で合成されます。また、その反応の初期段階の酵素は、アルギニンによってフィードバック阻害注4)を受けることが分かっています。これまでは、アルギニン生合成の初期段階に着目した研究が行われてきました。しかしながら、アルギニン生合成の最終段階であるオルニチン回路注5)に関する酵素の研究は、ラン藻ではあまり行われていませんでした。アルギニン生合成の最終段階では、アルギニノコハク酸リアーゼ(ArgH)によって、アルギニンとフマル酸が生成されます。
ArgHは、アルギニンを生成する酵素で、これまでに他の生物では細菌や藻類、高等植物や哺乳類などのArgHの生化学的性質は研究が行われていましたが、ラン藻においては生化学的な性質は知られていませんでした。また、生成物であるアルギニンのArgHへの阻害効果が報告されているのは、ウシやマツの一種だけでした。
そこで、私たちは、3種類のラン藻のArgH(SyArgH, ArArgH, NoArgH)の性質を調べ、その性質を比較しました。
2.研究手法と成果
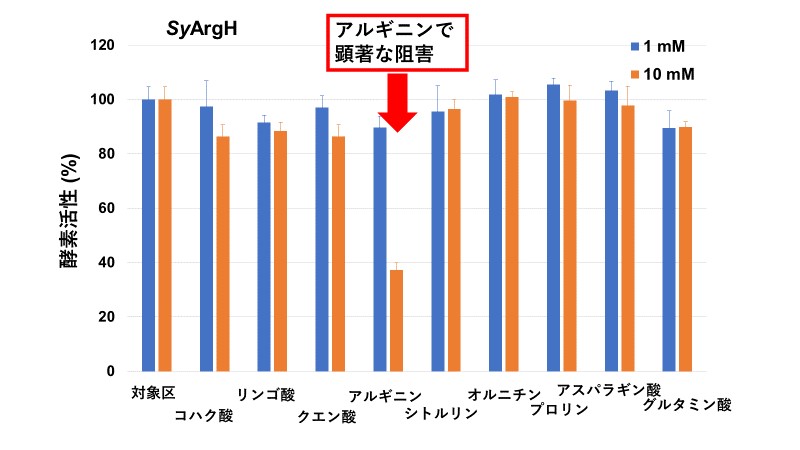
本研究グループは、組換えSyArgHタンパク質を大腸菌で発現させて精製し、その性質を評価しました。その結果、SyArgHは、45℃、pH 8.5の条件で最も高い活性を示しました。また、クエン酸回路やアルギニン生合成系にかかわる物質を添加して、酵素活性を測定しました。その結果、10 mMのアルギニンを添加することによって、37%まで酵素活性が低下することが分かりました(図1)。また、それ以外の物質を10 mMの濃度で添加しても顕著な酵素活性の低下は見られませんでした(図1)。
また、ラン藻のArgHのアミノ酸配列を比較し、系統樹を作成したところ、ラン藻の目によってそのグループが分かれることが分かりました(図2)。このことは、ラン藻のグループによって保存されている酵素の機能が類似している可能性を示唆します。この結果をもとに、糸状性ラン藻であるスピルリナ(ArArgH)、窒素固定を行うラン藻であるノストックのArgH(NoArgH)をSyArgHと同様に生化学的性質の解析を行いました。その結果、NoArgHは、SyArgHとArArgHよりも触媒効率が約3倍大きいことが分かりました。このことは、窒素固定を行うラン藻の方が、アルギニンを効率的に生合成していることを示唆しています。また、ArArgHとNoArgHもSyArgHと同様に、10 mMのアルギニンによって酵素活性が31%と27%まで低下することが分かりました。
また、アルギニンによく似た構造であるアミノ酸のリジンでは、ラン藻のArgHの酵素活性はアルギニンほど強い阻害を受けませんでした(図3)。これらの結果から、ラン藻のArgHへの阻害はアルギニン特異的であり、グループの異なるラン藻でもその阻害効果は保存されていることが分かりました。
以上の結果を踏まえて、アルギニンの濃度とpHを変化させて、ラン藻のArgHの酵素活性を測定しました。その結果、ラン藻のArgHに対するアルギニンの阻害はpH 8.0の時よりもpH 7.0の時の方が弱くなることが分かりました(図4)。このことは、光合成をしている時としていない時で細胞内のpHが変化するラン藻において、アルギニン代謝が変化している可能性を示唆しています。
このように、ラン藻のArgHに対するアルギニンの阻害は、ラン藻全体で保存されている可能性があり、さらにpHによって制御されている可能性を示唆しました。このことは、これまで報告されていたフィードバック阻害によるアルギニン生合成の初期反応の制御だけではなく、オルニチン回路内部においても制御されている可能性を示唆しました(図5)。
3.今後の期待
本研究グル-プは、3つのラン藻のArgHの性質を明らかにし、窒素を固定するシアノバクテリアのArgHが高い活性を持つことを発見しました。また、アルギニンによる阻害が3つのシアノバクテリア目に保存されており、pHによってその阻害が変化することを明らかにしました。
本研究成果は、アルギニノコハク酸リアーゼの生化学的性質やタンパク質の配列保存性の理解だけでなく、多くのエネルギーや還元力を利用するアルギニン生合成系の制御の解明にも利用されます。本研究は、ラン藻の窒素代謝とアルギニン生合成系の関係の解明に貢献されることが予想されます。このような酵素の生化学解析の知見が、遺伝子改変株での物質生産につながることは、バイオプラ原料となるジカルボン酸生産において実証されています注6。今後は、アルギニン生合成系の関連酵素の生化学解析をさらに進めることと、該当遺伝子改変株を構築することで、複雑なアルギニン生合成系の解明と、アミノ酸生産への応用につながることが期待されます。
4.論文情報
<タイトル>
Arginine inhibition of the argininosuccinate lyases is conserved among three orders in cyanobacteria
(日本語タイトル アルギニノコハク酸リアーゼのアルギニン阻害は3つの目のシアノバクテリアで保存されている)
<著者名>
Noriaki Katayama, Takashi Osanai
<雑誌>
Plant Molecular Biology
<DOI>
10.1007/s11103-022-01280-x.
5.補足説明
注1)シネコシスティス
株名:Synechocystis sp. PCC 6803。最も広く研究されている淡水性、単細胞性のラン藻。増殖が速く、直径が約1.5マイクロメートルの球形をしている。窒素固定を行わない。1996年に、ラン藻種の中で最初に全ゲノム配列が決定された。相同組換えによる遺伝子の改変が可能であり、凍結保存が可能であるなどの利点を有する。
注2)スピルリナ
株名:Arthrospira platensis NIES-39。窒素固定を行わないラン藻で、糸状体がらせん状に巻いた形をとっている。塩湖から単離されたラン藻であるため、好塩性で好アルカリな形質を有している。健康食品や食用色素の材料として産業的に用いられている。
注3)ノストック
株名:Nostoc sp. PCC 7120。細胞が数珠上につながっている糸状性の形態を持つ。窒素欠乏時に、ヘテロシストと呼ばれる窒素固定に特化した細胞を形成する。窒素固定や細胞分化に関する研究のモデル生物としても扱われている。
注4)フィードバック阻害
代謝系のある反応を触媒する酵素の活性が、その代謝系の生成物によって抑制される現象。本研究の例では、アルギニン生合成系の、NAGK(N-アセチルグルタミン酸キナーゼ)という酵素の活性が、アルギニンによって阻害される。
注5)オルニチン回路
アルギニン生合成系において、シトルリン、オルニチン、アルギニノコハク酸、アルギニンからなる代謝経路。尿素回路とも呼ばれ、生体内に有害なアンモニアを無害な尿素に変換する回路として知られているが、ラン藻においては尿素ではなくアンモニアを生成し、窒素源として再利用している。
注6)ジカルボン酸生産のプレスリリース
「〜二酸化炭素から発酵でつくるプラスチック原料〜 明治大学農学部環境バイオテクノロジー研究室が、 ラン藻のジカルボン酸生産の世界最高レベルを達成しました」(https://www.meiji.ac.jp/koho/press/6t5h7p00003akjuu.html)
参考図
図1:各代謝産物存在下のSyArgH酵素活性
縦軸は対象区を100%としたときの酵素活性を表す。青が1 mM、オレンジが10 mMの濃度で各代謝産物を添加したものを表す。
図2:ラン藻のArgHの分子系統樹
ラン藻のArgHのアミノ酸配列に基づいて作成した分子系統樹。ラン藻のArgHは、アミノ酸配列の違いで5つのグループに分かれた。本研究では、それぞれ異なるグループのラン藻のArgHを解析した。
図3:異なる濃度のリジン存在下でのラン藻のArgH酵素活性
縦軸は対象区を100%としたときの酵素活性を表す。緑はSyArgH、紫はNoArgH、青はArArgHの酵素活性を表す。
図4:アルギニン塩酸塩濃度とpHを変化させたときのラン藻のArgH酵素活性
縦軸はアルギニン塩酸塩濃度が0 mMの時の活性を100%としたときの酵素活性。青が反応液のpHを7.0、オレンジがpHを8.0としたときの酵素活性を表す。pH 7.0だと同濃度のアルギニン塩酸塩を加えたときに酵素活性が低下しにくい。
画像5: https://www.atpress.ne.jp/releases/311324/img_311324_5.jpg
図5:アルギニン生合成の概略
ラン藻のアルギニン生合成の概略図。グルタミン酸を出発物質として、複数の酵素反応(黒矢印)によって、アルギニンを生合成する。緑の棒線で示したものが、これまで知られていたアルギニン生合成の初期段階での、アルギニンによるフィードバック阻害。赤の棒線で示したものが、本研究で明らかになったアルギニンによるオルニチン回路内での阻害。










![[Amazon限定ブランド]CCL い・ろ・は・すラベルレス 2LPET ×8本 ミネラルウォーター 無味 製品画像:2位](https://m.media-amazon.com/images/I/41h0MHfvhkL._SL160_.jpg)














![2K対応 良品 13.3インチ Apple MacBook Air A2337 (2020年式) グレー シルバー / macOS 26 Tahoe/ 卓越性能Apple-M1/ 16GB [8GB選択可]/ 爆速NVMe式SSD [ 512GB / 256GB 選択可]/ カメラ/ 無線/ 【中古ノートパソコン 中古パソコン 中古PC】税込送料無料 即日発送 製品画像:3位](https://thumbnail.image.rakuten.co.jp/@0_mall/pc-one/cabinet/12865687/12865699/12877879/apple14-xxx-1.jpg?_ex=128x128)



![【25日限定P10倍+最大4,000円OFF+最大100%ポイントバック】 【3年保証】HP PRODESK 400 G4 DM [新品SSD] SSD256GB メモリ8GB Core i3 Windows 11 Pro 中古 返品 送料無料 中古デスクトップパソコン 中古パソコン デスクトップパソコン デスクトップ PC ミニPC OFFICE付き 製品画像:3位](https://thumbnail.image.rakuten.co.jp/@0_gold/pcwrap/goods/4bo257723_1.jpg?_ex=128x128)
![DELL|デル デスクトップパソコン ブラック SAD50-FN [モニター無し /Windows11 Home /intel Core Ultra 5 /メモリ:16GB /SSD:512GB /2025年夏モデル] 製品画像:2位](https://thumbnail.image.rakuten.co.jp/@0_mall/biccamera/cabinet/product/12848/00000014128860_a01.jpg?_ex=128x128)





![IOデータ 160Hz&4K対応ゲーミングモニター KH-GDU271JAD GigaCrysta [27型 / 4K(3840×2160) / ワイド / 320Hz] ブラック 製品画像:3位](https://thumbnail.image.rakuten.co.jp/@0_mall/r-kojima/cabinet/n0000001625/4957180183664_1.jpg?_ex=128x128)


![【楽天ブックス限定特典】乃木坂46川崎桜 1st写真集『エチュード』(限定カバー) [ 川崎桜 ] 製品画像:30位](https://thumbnail.image.rakuten.co.jp/@0_mall/book/cabinet/1009/2100014821009_1_3.jpg?_ex=128x128)
![【お得な5のつく日★全品P10倍】FASHION ARMY by Matthieu Nicol[作品集 ファッション ミリタリースタイル マチュー・ニコル] 製品画像:29位](https://thumbnail.image.rakuten.co.jp/@0_mall/okotico/cabinet/11127973/hob98_1.jpg?_ex=128x128)
![きらめきかわいいブック システムシール手帳特大号 (扶桑社ムック) [ サンリオ ] 製品画像:28位](https://thumbnail.image.rakuten.co.jp/@0_mall/book/cabinet/4392/9784594624392_1_3.jpg?_ex=128x128)
![周産期麻酔科学 [ 日本周産期麻酔科学会 ] 製品画像:27位](https://thumbnail.image.rakuten.co.jp/@0_mall/book/cabinet/5544/9784498055544_1_2.jpg?_ex=128x128)
![[楽譜] RikuRyu! 三浦璃来&木原龍一フォトブック【10,000円以上送料無料】(RikuRyu!ミウラリライ&キハラリュウイチフォトブック) 製品画像:26位](https://thumbnail.image.rakuten.co.jp/@0_mall/gakuhu/cabinet/m97844033/m9784403311581.jpg?_ex=128x128)


![ソダシ親子写真集 Heritage of White [ 宮澤 正明 ] 製品画像:23位](https://thumbnail.image.rakuten.co.jp/@0_mall/book/cabinet/1088/9784065401088_1_2.jpg?_ex=128x128)
![改訂版 本当の自由を手に入れる お金の大学 [ 両@リベ大学長 ] 製品画像:22位](https://thumbnail.image.rakuten.co.jp/@0_mall/book/cabinet/3780/9784023323780_1_3.jpg?_ex=128x128)
